Fizikteki tanımların bilgisi, çeşitli fiziksel problemleri başarılı bir şekilde çözmek için önemli bir faktördür. Makalede ideal bir gaz sistemi için izobarik, izokorik, izotermal ve adyabatik süreçlerin ne anlama geldiğini ele alacağız.
İdeal gaz ve denklemi
İzobarik, izokorik ve izotermal süreçlerin tanımına geçmeden önce ideal gazın ne olduğunu ele alalım. Fizikteki bu tanıma göre, her yöne yüksek hızlarda hareket eden çok sayıda boyutsuz ve etkileşimsiz parçacıklardan oluşan bir sistem düşünülür. Aslında, atomlar ve moleküller arasındaki mesafelerin boyutlarını çok aştığı ve parçacıkların etkileşiminin potansiyel enerjisinin kinetik enerjiye kıyasla küçüklüğü nedeniyle ihmal edildiği gaz halindeki bir küme halinden bahsediyoruz.
İdeal bir gazın durumu, termodinamik parametrelerinin toplamıdır. Ana olanlar sıcaklık, hacim ve basınçtır. Bunları sırasıyla T, V ve P harfleriyle gösterelim. XIX yüzyılın 30'larındaClapeyron (Fransız bilim adamı) ilk önce belirtilen termodinamik parametreleri tek bir eşitlik içinde birleştiren bir denklem yazdı. Şuna benziyor:
PV=nRT,
burada n ve R sırasıyla maddelerin miktarı ve gaz sabitidir.
Gazlardaki izoprosesler nelerdir?
Birçoğunun fark ettiği gibi, izobarik, izokorik ve izotermal süreçler adlarında aynı "iso" önekini kullanır. Geri kalan parametreler değişirken, tüm sürecin geçişi sırasında bir termodinamik parametrenin eşitliği anlamına gelir. Örneğin, bir izotermal süreç, sonuç olarak, sistemin mutlak sıcaklığının sabit tutulduğunu gösterirken, bir izokorik süreç sabit bir hacmi belirtir.
İzoprosesler çalışmak için uygundur, çünkü termodinamik parametrelerden birinin sabitlenmesi, genel gaz hali denkleminin basitleştirilmesine yol açar. Tüm bu izoprosesler için gaz yasalarının deneysel olarak keşfedildiğini belirtmek önemlidir. Analizleri, Clapeyron'un indirgenmiş evrensel denklemi elde etmesine izin verdi.
İzobarik, izokorik ve izotermal süreçler
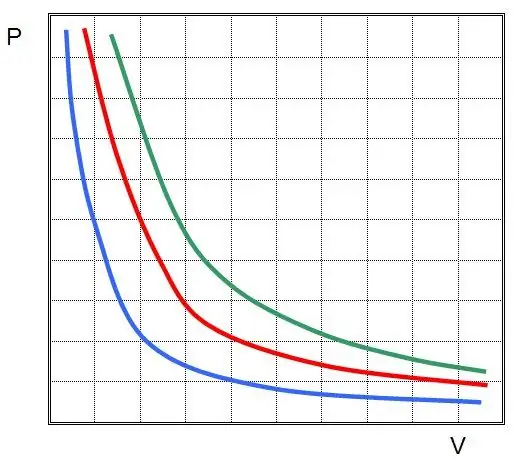
İdeal bir gazda izotermal bir süreç için ilk yasa keşfedildi. Şimdi Boyle-Mariotte yasası olarak adlandırılıyor. T değişmediği için durum denklemi eşitliği ifade eder:
PV=sabit
Başka bir deyişle, sistemdeki herhangi bir basınç değişikliği, gazın sıcaklığı sabit tutulursa hacminde ters orantılı bir değişikliğe yol açar. P(V) fonksiyonunun grafiğiabartma.
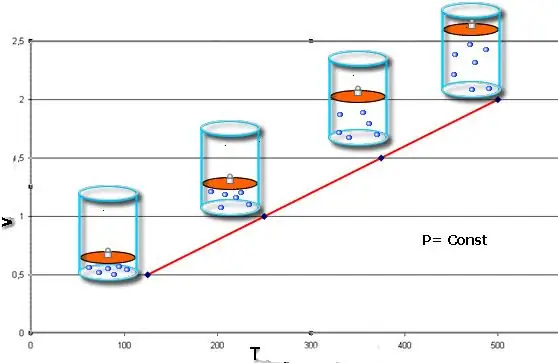
İzobarik süreç - bu, basıncın sabit kaldığı sistemin durumundaki bir değişikliktir. Clapeyron denklemindeki P değerini sabitledikten sonra şu yasayı elde ederiz:
V/T=sabit
Bu eşitlik, 18. yüzyılın sonunda alan Fransız fizikçi Jacques Charles'ın adını taşıyor. İzobar (V(T) fonksiyonunun grafik gösterimi) düz bir çizgi gibi görünür. Sistemdeki basınç ne kadar fazlaysa bu hat o kadar hızlı yükselir.
Gaz pistonun altında ısıtılırsa izobarik işlemin uygulanması kolaydır. İkincisinin molekülleri hızlarını (kinetik enerji) arttırır, piston üzerinde daha yüksek bir basınç oluşturur, bu da gazın genişlemesine ve sabit bir P değerinin korunmasına yol açar.
Son olarak, üçüncü izoproses izokoriktir. Sabit bir hacimle çalışır. Durum denkleminden karşılık gelen eşitliği elde ederiz:
P/T=sabit
Fizikçiler arasında Gay-Lussac yasası olarak bilinir. Basınç ve mutlak sıcaklık arasındaki doğru orantı, izobarik sürecin grafiği gibi izokorik sürecin grafiğinin de pozitif eğimli düz bir çizgi olduğunu gösterir.
Bütün izoproseslerin kapalı sistemlerde gerçekleştiğini anlamak önemlidir, yani n'nin değeri onların seyri sırasında korunur.
Adyabatik süreç
Bu süreç, geçiş sırasında üç termodinamik parametrenin tümü değiştiği için "iso" kategorisine ait değildir. adyabatikçevre ile ısı alışverişi yapmadığı sistemin iki durumu arasındaki geçiş olarak adlandırılır. Böylece sistemin genişlemesi, iç enerji rezervleri nedeniyle gerçekleştirilir, bu da içindeki basınçta ve mutlak sıcaklıkta önemli bir düşüşe neden olur.
İdeal bir gaz için adyabatik süreç Poisson denklemleriyle tanımlanır. Bunlardan biri aşağıda gösterilmiştir:
PVγ=const,
burada γ, sabit basınçta ve sabit hacimde ısı kapasitelerinin oranıdır.
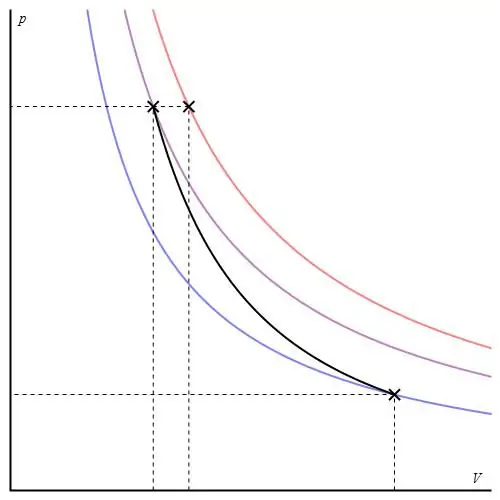
Adyabatik grafik, izokorik süreç grafiğinden ve izobarik grafikten farklıdır, ancak bir hiperbole (izoterm) benzer. P-V eksenlerindeki adiabat, izotermden daha keskin davranır.






